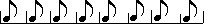Bottom of Analisa Parasetamol Metode Spektrofotometer UV-VIS
ANALISA PARASETAMOL DENGAN
SPEKTROFOTOMETER UV-VIS A. ACARA Analisa parasetamol dengan spektrofotometer
UV-VIS B. PRINSIP Pengukuran kadar parasetamol pada panjang gelombang maksimum
244 nm setelah sampel diencerkan. C. TUJUAN Mengetahui kadar parasetamol dalam
sampel D. DASAR TEORI a. Spektrofotometer Dalam analisis spektrofotometri
digunakan sumber radiasi yang menjorok kedalam daerah ulatraviolet spectrum
itu. Dari spectrum itu, dipilih panjang-panjang gelombang tertentu dengan lebar
pita kurang dari 1 nm. Instrument ini sebenarnya terdiri dari dua instrument
dalam satu kotak yaitu sebah spectrometer dan sebuah fotometer.
spektrofotometer optis adalah sebuah instrument yang mempunyai system optis
yang dapat menghasilkan sebaran (dispersi) radiasi elektromagnetik yang masuk,
dan dengan mana dapat dilakukan pengukuran kuantitas radiasi yang diteruskan
pada panjang gelombang terpilih dari jangka spectral itu. Sebuah fotometer
adalah peranti untuk mengukur intensitas radiasi yang diteruskan atau suatu
fungsi intensitas ini, bila digabungkan dalam spektrofotometer, spectrometer
dan fotometer itu digunakan secara gabungan untuk menghasilkan suatu isyarat
yang berpadanan dengan selisih antar radiasi yang diteruskan oleh bahan
pembanding dan radiasi yang diteruskan oleh contoh pada panjang-panjang
gelombang yang terpilih. b. Parasetamol Parasetamol atau asetaminofen
adalah obat analgesic dan antipiretik yang populer dan digunakan untuk melegakan
sakit kepala, sengal-sengal dan sakit ringan, dan demam. Digunakan dalam
sebagian besar resep obat analgesic salesma dan flu. Ia aman dalam dosis
standar, tetapi karena mudah didapati, overdosis obat baik sengaja atau tidak
sengaja sering terjadi. Struktur molekul parasetamol Parasetamol (Asetaminofen)
merupakan salah satu obat yang paling banyak digunakan sehari-hari. Obat ini
berfungsi sebagai pereda nyeri dan penurun panas. Setelah berpuluh tahun
digunakan, parasetamol terbukti sebagai obat yang aman dan efektif. Tetapi,
jika diminum dalam dosis berlebihan (overdosis), parasetamol dapat menimbulkan
kematian. Berbeda dengan obat analgesik yang lain seperti aspirin dan
ibuprofen, parasetamol tak memiliki sifat antiradang. Jadi parasetamol tidak tergolong
dalam obat jenis NSAID. Dalam dosis normal, parasetamol tidak menyakiti
permukaan dalam perut atau mengganggu gumpalan darah, ginjal atau duktus
arteriosus pada janin. Parasetamol dapat dijumpai di dalam berbagai macam obat,
baik sebagai bentuk tunggal atau berkombinasi dengan obat lain, seperti
misalnya obat flu dan batuk. Antidotum overdosis parasetamol adalah
N-asetilsistein (N-acetylcysteine, NAC). Antidotum ini efektif jika diberikan
dalam 8 jam setelah mengkonsumsi parasetamol dalam jumlah besar. NAC juga dapat
mencegah kerusakan hati jika diberikan lebih dini. Overdosis parasetamol dapat
menyebabkan kerusakan
hati. Jika kerusakan sangat berat,
mungkin perlu transplantasi hati agar korban bisa bertahan hidup. E. ALAT DAN
BAHAN 1. Alat
• Spektrofotometer UV
-VIS
• Neraca analitik • Spatula • Labu
ukur 10, 25, 50, 100, 250 mL • Batang pengaduk • corong gelas • Beaker glass
2. Bahan
• Parasetamol murni • Methanol • Aq
uadest F. PROSEDUR 1. Larutan
parasetamol standar a. larutan A (250 mg/L)
• menimbang 0,0625 g parasetamol
murni dan masukan dalam labu ukur 250 mL • melarutkannya dengan 10 mL methanol
• menambahkan aquadest sampai tanda batas
b. Larutan B
• memi
pet 50 mL larutan A dan
mengencerkannya dengan aquadest sampai 250 mL dalam labu ukur. 2. Pembuatan
larutan standar kerja
• mengambil larutan B sebanyak 5,00
; 10,00 ; 15,00 ; 20,00 ; dan 25,00 mL dan memasukannya
masing-masing kedalam labu ukur 100
mL, lalu menambahkan aquadest pada masing-masing labu ukur samapi tanda batas.
3. mengukur masing-
masing larutan standar pada λ
maksimal (200
-300 nm) 4. mengukur masing-
masing sampel pada λ maksimal, dan
menghitung konsentrasi sampel
dalam mg. G. DATA HASIL PENGAMATAN
1. Pengukuran larutan standar Standar C (ppm) A (Absorbansi) 1 0,25 0,2053 2 5
0,3657 3 7,5 0,5320 4 10 0,6977 5 12,5 0,8592
persamaan linier : Y = OX2 +
0,06559X+0,09004 r = 0,9999 2. Pengukuran sampel No Nama A (Absorbansi) C
(ppm) Volume larutan (mL) Cakhir (mg) Csebenarnya (mg) 1 Adhyatnika Nugraha
0,734 10,586 100 1,0586 1 2 Bertha Julisti 0,892 13,039 250 3,2598 3 3 Fauziah
0,364 4,9313 1250 6,1641 6 4 Rahma Eka A 0,564 7,9851 125 0,9981 1 5 Yenih
Kurniasih 0,679 9,7383 125 1,2172 1,25 H. PEMBAHASAN Sampel yang dipergunakan
dalam analisa kadar parasetamol dengan spektrofotometri UV-VIS adalah
parasetamol murni. Analisa parasetamol dalam sampel ini dilakukan oleh
masing-masing personel dan konsentrasi parasetamol dalam sampel telah
diketahui terlebih dahulu, dan hasil dari analisa oleh personel tersebut
dibandingkan dengan konsentrasi sebenarnya. Persiapan larutan deret standar
dilakukan dengan cara pengenceran dari larutan standar dengan konsentrasi 250
mg/L (ppm), larutan ini didapatkan dengan cara menimbang dengan teliti
parasetamol murni sebanyak 0,0625 g dan dilarutkan dengan methanol
sebanyak 10 mL kemudian ditambahkan aquadest sampai 250 mL pada labu ukur. Dari
larutan dengan konsentrasi 250 ppm ini kemudian dipipet sebanyak 50 mL dan
dimasukan kedalam labu ukur 250 mL, kemudian ditera dengan menggunakan
aquadest. pengenceran 5 kali ini diperoleh konsentrasi 50 ppm. dari konsentrasi
50 ppm ini merupakan larutan standar yang akan dipergunakan untuk membuat
larutan deret standar untuk pengukuran dengan spektrofotometer. Dengan memipet
larutan 50 ppm sebanyak 5,00 ; 10,00; 15,00 ; 20,00 ; dan 25,00 mL dan
masing-masing dimasukan kedalam labu ukur 100 mL maka dapat diketahui
konsentrasi dari masing-masing secara berurutan adalah 2,5 ; 5 ; 7,5 ; 10
; dan 12,5 ppm, hasil ini didapatkan dari hasil perhitungan menggunakan rumus pengenceran
: Keterangan : V1 : Volume awal N1 : Konsentarasi awal V2 : Volume akhir
N2 : Konsentrasi akhir Setelah konsentrasi dari larutan deret standar
diketahui, proses selanjutnya adalah pengukuran absorbansi dan konsentrasi
dengan spektrofotometer. dari hasil pengukuran maka dapat diketahui bahwa
nilai absorbansi dari larutan deret standar tersebut adalah : Standar C (ppm) A
(Absorbansi) 1 0,25 0,2053 2 5 0,3657 3 7,5 0,5320 4 10 0,6977 5 12,5 0,8592
ANALISA MAKANAN DAN MINUMAN
Definisi : Analisa adalah usaha
pemisahan suatu kesatuan materi bahan menjadi komponen-komponen penyusunnya
atau penguraian bahan menjadi senyawa –senyawa penyusunnya sehingga dapat
dipakai sebagai data untuk menentukan komposisi bahan.
Hal-hal yang penting untung dipertimbangkan
dalam pemilihan prosedur
1. Pengetahuan dasar komposisi suatu
bahan yang akan dianalisa
2. Tingkat ketelitian yang
dikehendaki.
3. Sampel yang tersedia.
Syarat prosedur analisa yang ideal
1.Sahih atau valid
2.Akurat( accuracy)
3.Presisi atau cermat ( Precission)
4.Cepat
5.Hemat
6.Tingkat keselamatan tinggi (
safety)
7.Keterulangan (Reproducibility)
8.(khusus) Specific
9.Dapat diandalkan (Reliable)
10.Mantab (Stable)
Tujuan Analisa Makanan dan Minuman
1.Menguraikan komponen – komponen
suatu bahan makanan kemudian memastikan jenis atau jumlahnya sehingga dapat
disusun komposisi keseluruhan bahan tersebut.
2.Menentukan adanya suatu komponen
bahan makanan – minuman kemudian memastikan berapa kadarnya sehingga dapat
ditentukan kualitas ( sesuai dengan UU ).
3.Menentukan komponen bahan atau
nutrien yang terkandung sehingga dapat dipakai patokan
Menyusun menu sehari-hari untuk diet
khusus.
4. Menentukan ada tidaknya bahan
ikutan atau BTM.
5.Mendeteksi adanya bahan metabolit
yang beracun.
6. Mengikuti terjadinya perubahan –
perubahan bahan yang terjadi baik kualitatif maupun kuantitatif selama proses
berlangsung (procces control )
Kerusakan Pada Sampel Yang Mungkin
Terjadi
1.Perubahan kimiawi ( oksidasi)
2.Perubahan enzimatis
3.Kontaminasi mikrobiologis
4.Perubahan Fisis
5.Perubahan Mekanis
KARBOHIDRAT
Karbohidrat merupakan sumber kalori
utama terutama untuk negara – negara berkembang. 1 gram karbohidrat
menghasilkan 4 kkal.
Fungsi karbohidrat
1.Sumber energi
2.Sumber serat
3.Penentu karakteristik bahan pangan
4.Mencegah pemecahan protein yang
berlebihan
5.Mencegah kehilangan mineral
6.Membantu metabolisme lemak dan
protein
Pembentukan karbohidrat secara alami
1.Merupakan hasil proses
fotosintesis
CO2 +
H2O → C6H12O6 + O2
2. Secara sintesis kimia misalnya
pembuatan sirup formosa yaitu dengan menambahkan larutan alkali encer pada
formaldehide
3. Mengekstrak dari bahan – bahan
nabati sumber karbohidrat
Karbohidrat Dalam Bahan Pangan
1.Pada tumbuhan : pati, pektin,
selulosa
2.Pada buah – buahan : glukosa dan
fruktosa
3.Pada hewan : glikogen
4.Pada susu : laktosa
Jenis – Jenis Karbohidrat
1.Monosakarida
A. Tata nama monosakarida
berdasarkan gugus fungsional yang dimiliki dan letak gugus hidroksilnya.
Misal : Aldosa : mengandung satu
gugus aldehid
Ketosa : mengandung satu gugus keton
Heksosa : Mempunyai 6 atom C
Pentosa : Mempunyai 5 atom C (
xylosa,arabinosa)
Fischer projection formula (dekstro
– levo)
OLIGOSAKARIDA
Oligosakarida adalah polimer
monosakarida yang terdri dari 2 – 10 molekul.Yang terdiri dari 2 molekul
disebut disakarida, contoh:
1.Sukrosa : glukosa dan fruktosa
2.Laktosa : glukosa dan galaktosa
3.Maltosa : glukosa dan glukosa
Ikatan yang menghuhungkan dua
molekul monosakarida disebut ikatan glikosidik.
Haworth projection
Pembentukan cincin
MALTOSA
LAKTOSA
SUKROSA
Ada tidaknya sifat mereduksi suatu
molekul gula ditentukan oleh ada tidaknya gugus hidroksil bebas yang reaktif.
1.Pada Aldosa (glukosa / dekstrosa)
gugus OH pada atom C-1 ( anomerik)
2.Pada ketosa (fruktosa / levulosa)
gugus OH pada atom C-2
POLISAKARIDA
1.Fungsi :
a. penguat tekstur : selulosa,
hemiselulosa, lignin, pektin
b. Sumber energi : pati, dekstrin,
glikogen, fruktan
PATI (AMILUM)
Merupakan homopolimer glukosa dengan
ikatan a-glikosidik. Terdiri dari 2 fraksi yang dapat dipisahkan dengan air
panas.
Fraksi terlarut disebut amilosa yang
mempunyai struktur lurus dengan ikatan a-(1,4) –D- glukosa.
Fraksi tak terlarut disebut
amilopektin mempunyai struktur cabang dengan ikatan a-(1,4) –D- glukosa 4 – 5 %
dari berat total.
SELULOSA
Merupakan serat – serat panjang yang
membentuk struktur jaringan pada dinding sel tanaman berantai lurus demgan
ikatana-(1,4) –D- glukosa.Turunan selulosa dikenal sebagai CMC yang dipakai
sebagai BTM dengan fungsi sebagai penghalus tekstur dan mencegah
retrogradasi.Pembuatan CMC dengan mereaksikan selulosa murni dengan NaOH
kemudian ditambah Na-Klorasetat.
ANALISA KARBOHIDRAT
A.Analisa Kualitatif
1.Uji Molish dengan prinsip
karbohidrat direaksikan dengan a- naftol dalam alkohol kemudian ditambah dengan
asam sulfat pekat melalui dinding tabung ,(+) bila terbentuk cincin ungu.
2.Uji Barfoed
Pereaksi terdiri dari Cu-asetat dan
asam asetat. Sampel ditambah pereksi kemudian dipanaskan,endapan merah bata
menunjukkan + monosakarida
3. Uji Benedict
Pereaksi terdiri dari Cu-sulfat,
Na-sitrat dan Na-karbonat.Sampel ditambah pereaksi dan dipanaskan adanya
endapan menunjukkan adanya gula reduksi.
4. Uji Iodin
Larutan sampel diasamkan dengan HCl
kemudian ditambah iodin dalam larutan KI.Warna biru berati (+) adanya pati
kalau warna merah (+) glikogen.
5. Uji Seliwanoff
Pereaksi 3.5 ml resocsinol 0,5 %
dengan 12 ml HCl pekat diencerkan 3,5 ml dengan aquades setelah sampel ditambah
pereaksi dipanaskan. Warna merah cerri menunjukkan + adanya fruktosa.
PENETAPAN KADAR KARBOHIDRAT
Cara Luff Schoorl
Prinsip :
R-OH + CuO ® Cu2O
+R-COOH
H2SO4 + CuO ® CuSO4
+ H2O
CuSO4 + 2KI ®
CuI2 + K2SO4
2CuI2
® Cu2I2 + I2
I2 + Na2S2O3 ® Na2S4O6 + NaI
I2 + amilum
® warna biru
PENETAPAN KADAR GULA REDUKSI
Prinsip: Monosakarida dioksidasi
oleh CuO dari reagen Luff Schoorl kemudian kelebihan CuO bereaksi dengan KI
dalam suasana asam membentuk I2 yang akan bereaksi dengan Na-tiosulfat dimana
indikator amilum berubah dari biru menjadi tidak berwarna.
Prosedur kerja PK gula reduksi
1. Timbang bahan 2,5-5 g masukkan
labu takar 100 ml.
2. Tambah aquades sampai tanda dan
larutkan.
3. Pipet 10 ml masukkan erlenmeyer
4.tambahkan reagen luff schoorl dan
panaskan diatas WB yang sudah mendidih.
5. Tambahkan 15 ml KI 20% dan 25 ml
H2SO4 4N ( awas hati-hati!).
6.Titrasi dengan Na-Thiosulfat 0,1 N
standar sampai warna kuning muda, tambah amilum 1% 1ml, lanjutkan titrasi
sampai warna biru hilang.
7.Lakukan blanko
Penetapan Kadar Gula Total
Metode : Iodometri
1.Timbang dengan seksama 5 g bahan
masukkan labu takar 100 ml.
2.Tambahkan aqudes sampai tanda dan
larutkan.
3.Pipet 25 ml sampel masukkan
erlenmeyer 250 ml tambahkan 25 ml HCl 30% panaskan WB selama 30 menit.
4.Dinginkan dan netralkan dengan
NaOH 30% cek dengan indikator.
5.Masukkan labu takar 250 ml tambah
aquades hingga tanda dan pipet 10 ml, selanjutnya kerjakan seperti gula
reduksi.
Penetapan Kadar Laktosa
1.Timbang bahan 5 g dengan seksama
dan tambah aqudes panas sampai susu larut.
2.Pindahkan ke labu takar 100 ml
secara kuantitatif dan tambahkan 5 ml Pb-asetat 10% dan 5 ml Ba(OH)2 10% dan
tepatkan sampai tanda.
3.Saring sampai didapat filtrat
jernih, kemudian pipet 10 ml masukkan erlenmeyer. Selanjutnya lihat penetapan
kadar gula reduksi.
Penghitungan Kadar Gula
Misal dari suatu praktikum
didapatkan hasil sbb :
1.Berat bahan 5 gram
2.Dimasukkan labu takar 100 ml
dipipet 5 ml ditepatkan labu takar 100 ml kemudian dipipet 25 ml.
3.Kadar larutan Na-tiosulfat =
0,0935 N
4.Titrasi sampel = 21,71 ml
5.Titrasi blanko = 31,95 ml
9.Na-Tiosulfat pada tabel kadarnya
0,1 N sehingga 10,24 ml Na-tiosulfat yang kadarnya 0,0935 N berubah menjadi
10,24 x 0,0935/0,1 = 9,574 ml.
10. Tabel hanya berisi angka bulat
sehingga angka 9,574 dilihat pada baris 9 dan 10.
9 ml ——– 22,4 mg
10 ml ——- 25,0 mg
11. Mencari kesetaraan pada 9,574 ml
= 22,4 mg + {( 9,574 – 9 ) / ( 10
–9)} x ( 25 –22,4) = 23,9924 mg
Menghitung kadar gula reduksi:
= fp I x fp II x kesetaraan / mg
bahan x 100%.
= 100/5 x 100/25 x 23,9924/5000 x
100%
= … %
PROTEIN
Protein adalah sumber asam – asam
amino yang mengandung unsur C, H, O, N ( Fe, Mn, Cu, S, P).
Fungsi protein dalam tubuh :
1. Zat pembangun
2. Zat pengatur
ASAM AMINO
Bila suatu protein dihidrolisa
dengan asam, atau enzim akan dihasilkan campuran asam – asam amino.
H
H
O
\ |
∥
N
— C
— C
/
|
\
H
R
OH
Asam amino dalam kondisi netral pH
isolistrik berada dalam kondisi ion dipolar atau zwitter ion pada pH rendah
gugus karboksil tidak terdisosiasi sedangkan gugus amino berada dalam bentuk
ion sebaliknya pada pH tinggi.
Untuk membentuk protein asam –asam
amino dihubungkan dengan ikatan peptida
Asam amino esensial
Asam amino esensial adalah asam
amino yang tidak dapat diproduksi dalam tubuh dengan cukup cepat untuk
mendukung pertumbuhan normal, misal : arginin, histidin, isoleusin, leusin,
lisin, metionin, fenilalanin, threoin, triptofan,valin
Asam amino nonesensial adalah asam
amino yang dapat diproduksi cukup dalam tubuh : alanin, asam aspartat, sitrolin,
sistein, asam glutamat.
Sifat – sifat Protein
1.Tidak larut dalam air
2.Dapat dihidrolisa dengan asam,
basa, dan enzim
3.Mempunyai 2 macam bentuk : serabut
( fibriler) dan bola ( globuler)
4.Bersifat amfoter
5.Dapat diendapkan oleh ion logam
berat, asam mineral kuat, garam – garam logam berat
6.Bisa mengalami denaturasi
●
ANALISA PROTEIN
METODE KJELDAHL
Prinsip : Penentuan protein
berdasarkan jumlah nitrogen dalam bahan.
1.Tahap Destruksi
Pada tahap ini bahan dipanaskan
dalam asam sulfat pekat dengan penambahan katalisator : K2SO4,Na2SO4 (
menaikkan titik didih). Cu,Se,Hg ( sebagai oksidator).
Pada tahap ini akan dihasilkan
(NH4)2 SO4
2. Tahap Destilasi
Pada tahap ini (NH4)2 SO4 dipecah
menjadi amonia ( NH3) dengan penambahan NaOH sampai alkalis dan
dipanaskan.Amonia yang dibebaskan selanjutnya ditangkap dengan asam standar (
HCl atau H3BO3).
(NH4)2 SO4 + NaOH → NH3
+ H2O +Na2SO4
3. Tahap titrasi
Bila menggunakan asam penangkap HCl
maka titran NaOH dan indikatornya pp.Reaksinya :
NH3
+ HCl → NH4Cl
% N = [(Vb-Vs) x N NaOH x 14 x 100
%]
mg sampel
% Protein = % N x Faktor konversi
Bila menggunakan asam penangkap asam
borat ( H3BO3) titrannya HCl sedangkan indikator MR.Reaksi :
NH4OH + H3BO3 → (NH4)3BO4 + H2O
% N = [(Vs-Vb) x N NaOH x 14 x 100
%]
mg sampel
% Protein = % N x Faktor konversi
LEMAK DN MINYAK
•Lemak dan minyak merupakan sumber
energi yang efektif karena 1 gram minyak / lemk dapat menghasilkan 9 kkal.
•* Lemak / minyak juga sebagai
sumber dan pelarut bagi vitamin A,D,E dan K.
•
Kelompok lipida
1.Kelompok trigliserida ( lemak,
minyak, asam lemak)
2.Kelompok turunan asam lemak (
lilin, aldehide, asam lemak).
3.Fosfolipid, glikolipid
4.Sterol dan steroida
5.Karotenoid
6.Kelompok lipida lain
●
Lemak tersabunkan
Lemak / minyak + NaOH→ garam Na –
asam lemak + gliserol.
Malam + NaOH → garam Na asam lemak +
alkohol.
Fosfolipid + NaOH → garam Na asam
lemak + gliserol + Na3PO4+ amina.
Sterol, pigmen,hidrokarbon + NaOH →
Pembentukan lemak
Sifat – sifat lemak / minyak
Sifat fisik
1.Tidak larut dalam air
2.Fiskositas meningkat bila
rantai C semakin panjang, suhu semakin rendah dan ikatan jenuh.
3.Berat jenis ( g/cm3) semakin
menigkat bila suhu rendah dan berat molekul tinggi dan ikatan jenuh.
4. Lemak berbentuk padat dan plastis
karena ada fase padat dan cair.
5.Titik cair semakin meningkat bila
rantai C semakin panjang.
Sifat kimia minyak
Dapat dihidrogenasi
Dapat dioksidasi
Dapat mengalami reksi iodisasi
Bereaksi dengan basa membentuk sabun
Penentuan kualitas minyak
1.Angka asam : jumlah mg basa yang
diperlukan untuk menetralkan asam lemak bebas dalam 1 gram lemak.
2.Angka Peroksida : ml equivalen
peroksida tiap kg minyak
Penentuan kadar minyak
1.Soxhletasi
2.Botol Babcock dan kaliper
TEKNOLOGI PENGOLAHAN MINYAK
1.Mutu Minyak
mutu suatu bahan menurut A.
Kramer dan BA Twigg, adalah gabuangan sifat –sifat khas yang dapat membedakan
setiap jenis bahan. Gabungan sifat khas tersebut sangat berpengaruh terhadap
penerimaan bahan oleh konsumen atau pembeli. Sifat khas yang dimaksud untuk
setiap bahan berbeda, sifat khas pada minyak berbeda dengan sifat khas pada
susu, daging dan sebagainya.Dalam hal ini bahan yang mempunyai gabungan sifat
khas seperti yang dikehendaki konsumen dikatakan bermutu baik. Di Indonesia
mutu yang baik dari berbagai bahan, termasuk minyak makan diberikan dalam
standard Industri Indonesia ( SII ).
2. Kerusakan Minyak
Proses perubahan atau kerusakan
minyak dapat berlangsung menurut beberpa cara.Pada dasarnya dapat dikelompokkan
menjadi dua peristiwa yaitu :
Hidroliss minyak, dihasilkan asam
lemak dan komponen lain, diikuti oleh oksidasi asam lemak tidak jenuh.
Oksidasi secara langsung terhadap
asam lemak tidak jenuh, diikuti oleh degradasi karena hidrolisis.
Hidrolisis merupakan proses peruaian
( lysis ) yang terjadi karena air ( hydro ). Peristiwa tersebut di percepat
oleh enzim yamg termasuk golongan lipase, perlkuan panas dan aksi dari senyawa
kimia. Dalam kondisi yang cocok, hidrolisis trigliserida dihasilkan asam lemak
dan gliserol
C3H5 ( COOCR ) 3 + 3
H2O → C3H5 ( OH ) 3 + 3 HOOCR
Trigliserida
air
gliserol
asam lemak bebas
Proses oksidasi minyak merupakan
proses perubahan minyak karena oksigen.Proses tersebut dipercepat oleh enzim
teritama enzim lipoksidase, oleh logam dan garamnyaatau orgnik komplek.
Oksidasi minyak dapat dibedakan menjadi oksidasi yang dikatalisis oleh enzim
lipoksigenase dan autooksidasi.Enzim lipoksigenase hanya menyerang ikatan 1,4
pentadiena. Asam lemk yang diserang oleh enzim tersebut misalnya asam linoleat,
asam linolenat dan asam arakidat. Autooksidasi merupakan reaksi antara oksigen
dan asam lemak tak jenuh. Proses oksidasi jenis ini disebut autooksidasi karena
reaksi makin dipercepat oleh hasil reaksi itu sendiri.
Autooksidasi sangat dipengaruhi oleh
besarnya derajat ketidakjenuhan asam lemak penyususn minyak. Reaksi oksidasi
ini dapat dipercepat oleh beberapa faktor, dintaranya suhu, sinar ultra violet,
radiasi ion sinar α, β, γ dan sinar X , peroksida, katalisatorlogam seperti Cu
dn Fe serta garamnya.
Faktor Penentu Mutu Minyak
Mutu minyak makan ditentukan oleh
beberapa sifat atau faktor yang disebut faktor penentu mutu. Sifat tersebut
menurut Standar Industri Indonesia yang ditetapkn oleh Departemen Perindustrian
Republik Indonesia meliputi kadar air, kadar asam bebas, bilangan yodium,
bilangan penyabunan, bilangan peroksida, kotoran, warna dan bau, minyak
pelikan.
1. Kadar Air
Miunyak kasar hasil ekstrasi maupun
minyak yang telah dimurnikan selalu mengandung air. Air dalam minyak sangat
berpengaruh terhadap daya simpan minyak. Semakin banyak air yang terkandung
minyak tersebut semakin mudh rusak. Pada mnyak kasar air dan kotoran merupakan
medium yang bak bagi mikroorganisme yang dapat merusak minyak.
Kadar air dalam minyak dapat
ditentukan dengn 2 cara yaitu cara pemanasan ( gravimetri) dan cara volumetri
atau destilasi.Pada cara pemanasan, minyak dipanaskan untuk menguapkan air.
Pengurangan berat minyak sebelum dan sesudah dipanaskan merupakan jumlah air
yang telah dapt diuapkan. Apabila pada pemenasan berikutnya sudah tidak ada
pengurangan berat lagi berarti yang terdapat dalam minyak dianggap sudah habis.
Sehingga pengurangan berat tersebut menggambarkan jumlah air yang terdapat
dalam minyak.
Pada cara destilasi minyak dicampur
dengan pelarut toluena atau xylena, dlam alat destilasi kemudian dipanaskan
sampai titik didih pelarut. Up yang terbentuk didinginkn dalam unit
destilasitrebut kemudian ditampung dalam penampung berskala.Pelarut yang digunaka
mempunyai titik didih yang lebih tinggi daripada air dan mempunyai berat jenis
lebih rendah daripada air serta tidak bercampur dengan air.Apabila pelarut
tersebut sudah mendidih berarti air dalam minyak sudah menguap semua. Air yang
menguap adalah air dalam minyak.Jumlah air dapat dilihat dari skala dalam
penampung. Kadar air dapat dibaca pada skala karena air akan terletak dibawah
sedang pelarut diatas.
Cara uji kadar air seperti pada
Standar Industri Indonesia adalah sebagai berikut :
1.Sebuah botol timbang diisi 10 – 15
g pasir laut halus dan murni atau serbuk asbes, berikut sebuah pengaduk pendek.
2.Botol timbang beserta isinya
dikeringkan selama 1 jam pada suhu 105 oC lalu didinginkan dan ditimbang.
3.Kedalam botol timbang trsebut
dimasukkan 5 gram sampel dan diaduk hingga homogen.
4.Kemudian dikeringakan pada
suhu 105 oC selama 15 menit didinginkan dan ditimbang hingga bobot konstan.
2. Kadar Asam Lemak Bebas
Asam lemak bebas dalam minyak tidak
dikehendaki, karena degradasi senyawa tersebut lebih lanjut menghasilkan produk
yang berpengaruh terhadap rasa dan bau yang tidak disukai dalam minyak. Makin
besar kadar asam lemak bebas dalam minyak maka kualitasnya semakin
rendah.Minyak yang ban6yak mengandung asam lemak bebas tidak tahan disimpan lama.
Banyaknya asam lemak bebas yang dikandung minyak dapat ditentukan berdasarkan
jumlah basa yang diperlukan untuk menetralkan minyak. Besar kandungan asam
lemak bebas dapat dinyatakan dalam persen asam lemak bebas atau dalam bentuk
angka asam.
Cara uji kadar asam lemak bebas yang
dihitung berdasarkan asam laurat adalah sebagai berikut :
Timbang 10 g sampel dalam
erlenmeyer.
Tambah 50 ml campuran alkohol –
benzol ( 1:1 ) netral.
Titrasi dengan NaOH 0,1 N standar
dengan indikator pp.
Titrasi sampai warna merah muda
tidak hilang selama 1 menit.
Asam Lemak Bebas
= ml x N x 0,205 x 100
( sbg asam laurat
)
—————————-
gram sampel
3. Bilangan Penyabunan
Bilangan penyabunan adalah bilangan
yang menujukkan jumlah miligram KOH yang
Diprlukan untuk menyabunkan 1 gram
lemak / minyak. Minyak dengan berat molekul rendah, mempunyai bilangan
penyabunan yang lebih besar daripada yang mempunyai rantai karbon panjang
dengan berat molekul tingi.
Angka penyabunan dapat ditentukan
berdasarkan jumlah KOH yang diperlukan untuk menyabunkan asam lemak bebas, dan
asam lemak yang masih terikat dalam bentuk trigliserida, dalam 1 gram minyak.
Minyak ditambah larutan basa berlebihan, kemudian kelebihan basa dititrasi
dengan asam. Selisih antara basa yang ditambahkan pada minyak dengan basa yang
tertisa adalah merupakan basa yang diperlukan untuk penyabunan.
3. Bilangan Penyabunan
Bilangan penyabunan adalah bilangan
yang menujukkan jumlah miligram KOH yang
Diprlukan untuk menyabunkan 1 gram
lemak / minyak. Minyak dengan berat molekul rendah, mempunyai bilangan
penyabunan yang lebih besar daripada yang mempunyai rantai karbon panjang
dengan berat molekul tingi.
Angka penyabunan dapat ditentukan
berdasarkan jumlah KOH yang diperlukan untuk menyabunkan asam lemak bebas, dan
asam lemak yang masih terikat dalam bentuk trigliserida, dalam 1 gram minyak.
Minyak ditambah larutan basa berlebihan, kemudian kelebihan basa dititrasi
dengan asam. Selisih antara basa yang ditambahkan pada minyak dengan basa yang
tertisa adalah merupakan basa yang diperlukan untuk penyabunan.
Cara uji bilangan penyabunan menurut
Standard Industri Indonesia adalah sebagai berikut :
± 2 g contoh ditimbang ke dalam
Erlenmeyer 500 ml.Tambahkan 25 ml alkohol-KOH 0,5 N (50 g KOH dilarutkan dengan
25 ml air dan diencerkan dengan alkohol 95 % hingga 1 liter).
Lalu Erlenmeyer dihubungkan dengan
pendingin udara (pendingin tegak) dan didihkan atas penangas air selama ½ jam.
Kemudian didinginkan dan dititar
dengan HCL 0,5 N dan p.p. sebagai penunjuk (misalnya diperlukan a ml).
Blanko (tanpa contoh) dikerjakan
juga seperti tersebut di atas (misalnya diperlukan b ml HCL 0,5 N).
Bilangan penyabunan = (b – a) ml
x N x 56,1
g contoh
4. Bilangan Yodium
Bilangan yodium adalah jumlah gram
yodium atau komponen yodium yang diabsorbsi oleh 100 g minyak.Yodium akan
bereaksi dengan ikatan rangkap pada asam lemak tidak jenuh.Oleh karena itu
angka yodium ini digunakan untuk menunjukkan derajat ketidakjenuhan asam lemak
penyusun minyak.
Angka yodium dapat ditentukan dengan
melarutkan minyak dalam kloroform atau karbon tetraklorida dan ditambah halogen
berlebihan.Kelebihan halogen kemudian dititrasi dengan larutan tiosianat,
sehingga jumlah yodium/halogen yang bereaksi dapat dihitung.
Cara uji bilangan yodium menurut
Standard Industri Indonesia adalah sebagai berikut :
0,5 g contoh ditimbang ke dalam
sebuah Erlenmeyer 300 ml bertutup basah dan dilarutkan dengan 15 ml
tetra.Dengan pipet 25 ml (jangan isap dengan mulut) tambahkan 25 ml larutan
WIJS dan disimpan selama ½ jam dalam tempat/ruangan gelap.Larutan WIJS dibuat
sebagai berikut : 15 g jod dilarutkan dalam 1 liter asam acetat pekat (99 %)
dan dialiri gas chlor (tidak boleh berlebihan), hingga sejumlah chlor yang
terikat setara dengan jod, yaitu diperlukan 3,6 g chlor.Untuk mengetahui
apakah jumlah tersebut sudah cukup, Erlenmeyer berisi larutan asam asetat
ditimbang sebelum dan sesudah dialiri gas chlor atau cara lain ialah dengan
memperhatikan perubahan warna dari coklat tua menjadi coklat
kekuning-kuningan.Larutan Wijs dimasukkan dalam botol berwarna dan disimpan
dalam tempat gelap.Lrutan Wijs tidak boleh dipakai lebih dari 1 bulan.
Sesudah penambahan larutan Wijs
tersebut di atas (dan disimpan selama ½ jam) lalu ditambah 10 ml KJ 30 % dan 10
ml air Erlenmeyer segera ditutup.Akhirnya dititar dengan tio 0,1 N dan sebagai
penunjuk dipergunakan larutan kanji (misalnya diperlukan larutan a ml tio 0,1
N).Blanko (tanpa contoh) dikerjakan seperti tersebut di atas (misalnya
diperlukan b ml tio 0,1 N)
Bilangan jod = (b-a)ml x titar
tio x 0,1269
g contoh
5. Kadar Kotoran (bahan asing)
Kotoran atau bahan asing dalam
minyak pada umumnya ditentukan dengan kadar air, kadar bahan yang tidak larut,
dan bahan yang tidak tersabunkan.Gabungan dari bahan tersebut disingkat dengan
M.I.U., yaitu kependekan dari ”Moisture, Insaluble, Unsaponifiable”.Kotoran
dalam minyak dapat mempercepat kerusakan minyak, oleh karena itu diusahakan
agar minyak tidak mengandung kotoran.Minyak yang mengandung kotoran makin
banyak, dianggap mempunyai kualitas yang makin tidak baik.
Menurut Standard Industri Indonesia,
yang dimaksud kotoran dalam minyak adalah bahan yang tidak larut dalam pelarut
minyak petroleum ether.Cara uji kotoran adalah sebagai berikut :
Sebuah kertas saring bulat (Whatman
No.40,41 atau 42) dikeringkan pada suhu 105ºC, didinginkan selama 15 menit dan
ditimbang.
Ke dalam sebuah Erlemeyer 300 ml
ditimbang ±20 g contoh dan dilarutkan dengan petroleum-ether.Kemudian disaring
dengan kertas saring yang telah ditimbang tersebut di atas.Lalu dicuci dengan
petroleum-ether hingga saringan bebas dari minyak (bila di kertas saring dengan
isinya) dikeringkan pada suhu 105ºC selama 1 jam, didinginkan selama 30 menit
dan ditimbang hingga bobotnya tetap.
Kadar kotoran = Penambah berat
x 100%
g contoh
6. Bilangan Peroksida
Peroksida merupakan senyawa antara
dalam rangkaian proses ketengikan minyak oleh peristiwa oksidasi.Bilangan
peroksida adalah bilangan yang menggambarkan jumlah oksigen dalam miliekuivalen
yang terdapat dalam 100 g minyak.Senyawa peroksida bukan senyawa yang berbau
”tengik”.Apabila jumlah senyawa peroksida dalam minyak makin banyak menunjukkan
minyak tersebut akan cepat menjadi tengik atau ”rancid”.Dengan demikian
peroksida tidak dikehendaki dalam minyak, atau kalau senyawa tersebut terdapat
dalam minyak jumlahnya perlu dibatasi.Bilangan peroksida dapat ditentukan
dengan beberapa cara, di antaranya adalah dengan cara Titrasi-Yodometri;
Polarometri dan Spektrofotometri,
Cara uji senyawa peroksida dalam
minyak, menurut Standard Industri Indonesia, adalah sebagai berikut:
± 5 g contoh ditimbang dalam
Erlenmeyer 300 ml bertutup basah.Lalu ditambahkan 30 ml larutan dari suatu
campuran terdiri dari 20 ml asam asetat pekat, 25 ml alkohol 95% dan 55 ml
chloroform.Kemudian ditambahkan 1 g KJ dan dibiarkan di tempat gelap selama ½
jam sambil dicampur benar-benar.Akhirnya ditambah 50 ml air dan dititar (pakai
mikroburet) dengan tio 0,002 N sebagai penunjuk dipergunakan larutan kanji
(misalnya diperlukan a ml).Blanko (tanpa contoh) dikerjakan juga seperti
tersebut di atas (mislanya diperlukan b ml tio 0,002 N).
Bilangan peroksida =(a-b) x N x 8
x 100
g contoh
7. Warna dan Bau Minyak
Trigliserida merupakan senyawa yang
tidak berwarna dan tidak berbau.Oleh karena itu minyak murni seharusnya juga
tidak berwarna dan tidak berbau.Akan tetapi di dalam praktek sering didapatkan
minyak murni tersebut berwarna ke arah kuning atau ke arah merah jingga, dan
masih berbau khas sesuai dengan bau sumber minyak tersebut.Hal ini mungkin
disebabkan karena pertimbangan ekonomis, atau karena kehendak konsumen.
8. Minyak Pelikan
Minyak pelikan dalam minyak makan
tidak dikehendaki, karena kecuali dianggap pemalsuan juga berpengaruh terhadap
penyimpangan sifat minyak makan yang sebenarnya.
Cara uji untuk menentukan apakah
minyak makan mengandung minyak pelikan atau tidak, menurut Standard Industri
Indonesia dapat dilakukan sebagai berikut :
Sedikit (1 ml) contoh ditambah
alkohol-KOH 0,5 N 5 ml dan dipanaskan.Kemudian ditambah air, jika larutan
menjadi keruh menunjukkan adanya minyak pelikan.Selanjutnya kadar minyak
pelikan dihitung dari sisa yang tak tersabun.
PENETAPAN KADAR LEMAK
METODE
● Soxhletasi
DASAR TEORI
∞ Lemak dan minyak merupakan
salah satu kelompok yang termasuk golongan lipida.Satu sifat yang
khas golongan lipida adalah daya pelarut
organic.Misalnya: eter, benzene, chloroform.
IV. ALAT DAN BAHAN
Alat: – Soxhlet
- Corong kaca
- Labu alas bulat
- Lampu spirtus
- Statip + klem
Bahan: – Sample (margarine)
- Kertas saring dan tali
- Pelarut = CHCl3 : methanol
2
: 1
PROSEDUR
▪ Timbang kurang lebih 5 gr
sample dengan kaca arloji.
▪ Timbang kertas saring dan
tali, bungkus sample dengan kertas saring dan ikat.Masukkan dalam soxhlet.
▪ Tambahkan pelarut 1,5 -2
kali volume soxhlet.
▪ Pasang alat sedemikian
rupa.Panaskan dengan lampu spirtus/kompor listrik.Tunggu sampai beberapa
sirkulasi sample sampai semua lemak habis terekstraksi.
▪ L.A.B → dilepas, sisa
pelarut diuapkan → timbang sampai bobot konstan.
STANDAR MUTU MINYAK
Standar mutu berbagai minyak makan
dalam perdagangan yang telah ditetapkan oleh Departemen Perindustrian Republik
Indonesia, dalam bentuk Standar Industri Indonesia, di antaranya adalah untuk
minyak kelapa, miyak sawit dan minyak goreng.
1. Mutu Minyak Kelapa
Minyak kelapa yang dimaksud adalah
minyak yang diperoleh dengan cara pengempaan kopra atau hasil ekstraksi bungkil
kopra.
Syarat mutu minyak kelapa meliputi :
3.1.
Air……………………………………………………………… maks. 0,5%
3.2. Kotoran……………………………………………………….
maks. 0,05%
3.3. Bilangan jod (g jod/100 g
contoh)………………….. 8-10,0
3.4. Bilangan penyabunan (mg KOH/g
contoh)……… 255-265
3.5. Bilangan peroksida (mg KOH/g
contoh)…………. maks. 5,0
3.6. Asam lemak bebas (dihitung
sebagai asam
laurat)………………………………………………………….
maks.5%
3.7. Warna,
bau………………………………………………….. normal
3.8. Minyak
pelikan……………………………………………. negatif
3.9. Untuk industri makanan tidak
boleh mengandung
logam-logam berbahaya dan arsen.
2. Mutu Minyak Kelapa Sawit
Minyak kelapa sawit adalah minyak
yang diperoleh dari ekstraksi sabut buah kelapa sawit.
Syarat mutu minyak kelapa sawit
adalah meliputi :
1.Air……………………………………………….maks.0,5%
2.Kotoran…………………………………………maks. 0,5
3.Bilangan jod (g jod/100 g
contoh)…….44-58
4.Bilangan penyabunan (mg
KOH/contoh)..195-205
5.Bilangan peroksida (mg oksigen/100
gcontoh) ………………………….maks. 3,0
6.Asam lemak bebas
(dihitung)………….maks.5%
7.Warna…………………………………………………….Normal
8.Bau………………………………………………………..Normal
9.Minyak pelikan………………………………………..negatif
3. Mutu Minyak Goreng
Minyak goreng yang dimaksud adalah
minyak nabati yang telah dimurnikan, digunakan sebagai bahan makanan.
Syarat mutu minyak goreng adalah
sebagai berikut :
Air………………………………………… maks. 0,3%
Bilangan peroksida…………………..maks. 1,0
mg oksigen/100 g
Asam lemak bebas (sebagai asam
laurat)………… maks. 0,3%
Logam-logam berbahaya (Pb,Cu,Hg,dan
As)…………. negatif
Minyak
pelikan…………………………………………………… negatif
Keadaan (bau, warna,
rasa)…………………………………… Normal
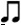
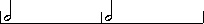
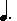 menghitung durasinya 1 + (1/2*1) = 1 1/2. Kalau dibuat rumus matematika not bertitik = n + 1/2n. hehehehe…
menghitung durasinya 1 + (1/2*1) = 1 1/2. Kalau dibuat rumus matematika not bertitik = n + 1/2n. hehehehe…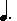 menghitung durasinya 1 + (1/2*1) = 1 1/2. Kalau dibuat rumus matematika not bertitik = n + 1/2n. hehehehe…
menghitung durasinya 1 + (1/2*1) = 1 1/2. Kalau dibuat rumus matematika not bertitik = n + 1/2n. hehehehe…